氧化应激对诱导DM大鼠及胰腺相关基因表达的影响
摘要
氧化应激参与了糖尿病(diabetes mellitus,DM)及其并发症的发生,为了观察氧化应激在糖尿病发生发展过程中的作用以及抗氧化剂干预对糖尿病的影响,作者用链脲佐菌素(streptozotocin,STZ)诱导建立DM大鼠模型,并进行氧化应激和抗氧化干预,检测血糖、胰岛素、超氧化物歧化酶(superoxide dismutase,SOD)、总抗氧化能力(total antioxidant capacity ,T-AOC)、丙二醛(malondialdehyde,MDA)及相关基因表达。结果发现氧化应激处理组(OS)的血糖与对照组(NC)相比其增幅较糖尿病组(DM)高,而抗氧化干预组(AO)血糖在后期呈降低趋势;SOD酶活性、T-AOC抗氧化水平指标在各组的变化趋势为NC>AO>DM>OS;MDA各组的变化趋势则与SOD、T-AOC相反,为NC<AO<DM<OS。AO和NC组胰腺组织Mn-SOD基因表达水平明显高于DM和OS组,而P53基因表达水平则明显低于DM和OS组。以上结果说明体内氧化还原水平可影响STZ所诱导的糖尿病大鼠的血糖;并提示氧化应激可改变体内氧化还原环境,从而可能加剧糖尿病的症状;而早期控制体内氧化应激水平对糖尿病进程有一定缓解作用;揭示Mn-SOD 和P53基因可能参与了对胰岛素分泌和血糖代谢的调控。
引言
糖尿病是体内以葡萄糖代谢发生紊乱为主的一种内分泌疾病,在我国发病率较高。糖尿病的病因迄今尚不很明确,现大多数学者认为其病因为多因素,并发现与氧化应激和活性氧介入有关[1-2]。
活性氧(reactive oxygen species,ROS)是具自由基活泼性质的分子,主要包括超氧阴离子(O2·-)、羟自由基(·OH)和过氧化氢( H2O2)等。机体内源性ROS可以通过线粒体电子传递链过程中的电子泄漏产生,也可以直接由氧化剂或氧化酶类(如FeSO4、黄嘌呤氧化酶、NADPH氧化酶等)介导产生。ROS在体内产生过多会导致机体组织和细胞的氧化损伤[3-4]。正常人体内存在完善的抗氧化损伤防御系统,包括有可清除自由基的各种抗氧化剂和各种抗氧化酶,从而可维持体内氧化还原水平的动态平衡;所以正常新陈代谢过程中产生的ROS自由基一般不会对人体产生危害,但一旦平衡被破坏,自由基过剩就有可能造成对机体组织的损害,进而可引起疾病的发生 [5]。
许多实验表明,糖尿病患者体内氧化应激水平较高,且体内氧化还原平衡的破坏程度与糖尿病的发生及病情发展密切相关[6]。由于ROS在糖尿病的发生发展过程中所起的作用,抗氧化剂在糖尿病防治中的应用越来越受到人们的重视,我们在实验设计中将大鼠随机分成正常对照组(NC)、普通糖尿病组(DM)、糖尿病氧应激组(OS)、糖尿病抗氧化组(AO)。采用链脲佐菌素(streptozotocin,STZ)诱导建立糖尿病模型,并同时用0.15%的FeSO4及课题组提取的具抗氧化作用的多糖肽(SPS)分别作为氧应激及抗氧化饲食干预。各组分别动态监测血糖、胰岛素、SOD(superoxide dismutase)指标;于28d测定血浆MDA(malondialdehyde)和T-AOC(total antioxidant capacity)水平;并检测胰腺组织中Mn-SOD、CuZn-SOD及p53的基因表达。
结果
1 空腹血糖
注射STZ 后,各试验组与对照组相比,都呈升高趋势,但氧应激处理OS组血糖升高幅度较DM组及AO组明显(表2),显示体内氧化应激过剩积累有可能促进糖代谢紊乱的发生。
AO组的血糖28d较14d明显下降,并显著低于同时间点的OS和DM组,表明采用抗氧化干预对DM鼠血糖升高具有一定抑制作用。
2 胰岛素测定值
注射STZ后14d各试验组胰岛素检测值明显升高,然后稍呈下降趋势,其中OS组降低幅度相对较大(表3)。这反映胰岛素分泌功能对氧化应激较敏感,加重应激可能会致胰岛β细胞氧化损伤而抑制胰岛素分泌。
3 SOD活性
注射STZ后,DM和OS组大鼠的SOD活力明显低于正常对照组,各组SOD活力按NC>AO>DM>OS而呈逐渐降低趋势(表4)。
4 MDA和T-AOC的水平变化
28d各试验组大鼠MDA均明显高于正常对照组,而T-AOC则明显低于正常对照组。各组MDA的变化趋势为NCAO>DM>OS(图1)。表明外源性干预会影响体内氧化还原环境。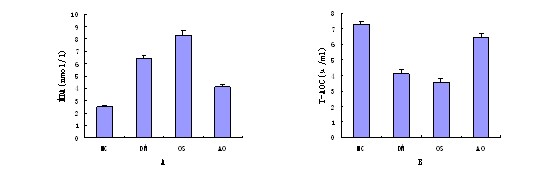
图1 各组大鼠注射STZ28d后MDA和T-AOC的水平变化
注:注射STZ 28d后,各组大鼠MDA的变化趋势为NC
5 相关基因表达水平
各组胰腺组织Mn-SOD mRNA表达水平依次为NC>AO>DM>OS,其中NC和AO组明显高于DM和OS组。CuZn-SOD mRNA表达各组无明显差异。P53 mRNA表达水平各组依次为OS>DM>NC>AO(图2)。
讨论
STZ是一种烷化剂,实验证明,在诱导实验性糖尿病大鼠过程中可使胰岛细胞内ROS水平提高[11-12],从而使胰岛细胞DNA受到氧化损伤并产生链断裂;进而会导致β-细胞坏死。Papaccio认为STZ诱导糖尿病过程中,抗氧化体系受损是使β-细胞受损害的先决条件[13]。这些研究结果也都表明人们已注意到氧化还原水平在糖尿病的诱发过程中的重要作用。本文验证了大鼠在STZ诱导DM过程中体内抗氧化酶SOD活性是呈明显下调趋势,而反映自由基损伤程度指标即脂质过氧化代谢产物MDA水平呈升高趋势,并与正常对照组相比有显著性差异。
实验证明FeSO4干预可促进体内氧化应激水平升高[14-15],在采用STZ(50mg/kg) 低浓度注射诱导DM大鼠模型过程中,糖尿病DM组和FeSO4氧应激加强处理的OS组胰岛素分泌和血糖值在诱导早期呈并行升高趋势,表明一定程度氧化应激干预也可促使胰岛素应激性分泌增加;但在28d OS组大鼠血糖进一步升高,而胰岛素却出现明显降低趋势,提示胰岛细胞因氧化损伤过重而使胰岛素分泌受到抑制,这反映STZ在诱发糖尿病过程中由于氧化应激的强度不同而具有诱导胰岛素分泌和进而损伤性抑制胰岛素分泌的两面性作用。也提示随氧化应激程度加重,由胰岛素抵抗可发展为胰岛素分泌受抑制,这也解释了2型糖尿病随病情发展会出现胰岛素分泌不足的原因。
食用菌多糖具有抗氧化作用已有许多研究报道[16-17],虽然在研究STZ诱导DM大鼠模型也有一些采用具抗氧化作用的类似天然植物有效提取成分进行抗氧化干预的报道[18-21],但尚未有灵芝糖肽类结合STZ干预和与FeSO4应激干预相比较的模型研究报道。FeSO4在体内以二价鉄离子形式通过Fenton效应可产生毒素很强的羟基自由基(·OH),从而加大氧化应激力度;SPS多糖肽具很强的抗氧化作用;通过这一模型组合,有助于观察氧化还原环境差异对诱发DM大鼠进程的影响。研究显示经加服SPS的AO组大鼠血液中SOD酶活性比DM组高,而氧化应激干预的OS组SOD酶活性最低,即按NC>AO>DM>OS顺序呈逐渐降低;与28d血糖指标排列顺序正好对应,按NC<AO<DM<OS逐渐升高。表明氧化应激通过对SOD酶活的抑制可促使糖代谢的异常,进行SPS干预可有助修复DM大鼠受损的SOD抗氧化酶的活性。检测各组大鼠胰腺组织CuZnSOD mRNA基因表达无明显差异,但MnSODmRNA表达却差异显著,其中OS组的MnSOD mRNA表达最低。MnSOD主要存在于线粒体内,而线粒体是体内产生自由基的重要源头,表明STZ诱导糖尿病大鼠,可能与影响胰岛细胞线粒体抗氧化酶的表达有关,MnSOD抗氧化酶可特异清除超氧阴离子自由基(O2·-),后者可通过Haber-Weiss效应:H2O2+ O2·-+H+ → ·OH+H2O+1O2 ,可产生毒素更强的活性氧自由基·OH和1O2,因MnSOD表达下调使清除自由基能力下降从而破环胰岛细胞线粒体的氧化还原平衡环境,进而就会导致对胰岛细胞和分泌功能的损伤。
p53是抑癌基因[22-23],正常情况下,细胞中p53蛋白含量很低,p53可促进细胞凋亡或使细胞生长停滞在G1期[24],本实验结果显示各组大鼠胰腺p53mRNA基因表达水平中OS组最高;而OS组28d较14d胰岛素水平明显降低,但血糖水平呈升高趋势。说明氧应激OS组从胰岛素抵抗逐步发展为胰岛素分泌受抑制,其原因可能与FeSO4氧化应激通过上调p53介导胰岛细胞的凋亡有关。抗氧化干预AO组随干预时间延长SOD酶活性呈上升趋势,血糖值有所下降,且血浆MDA下降;另外AO实验组MnSOD抗氧化酶基因表达较高,而P53促凋亡基因表达相反较低。这些结果提示,STZ和氧化应激可能通过SOD、P53基因参与糖尿病的发病过程,而采用外源性抗氧化剂持续干预,可能对STZ引起的胰岛素抵抗和胰岛细胞损伤具有一定防护作用。实验结果也说明对机体氧化还原水平如进行有效调节可有助于对糖尿病病程的控制;这为深入研究糖尿病的预防和综合治疗提供了一个新的思路。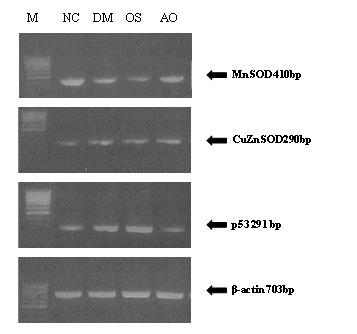
图2 各组大鼠基因表达电泳图
注:注射STZ 28d后,各组大鼠胰腺组织Mn-SOD mRNA表达水平依次为:NC>AO>DM>OS, 而P53 mRNA表达水平:OS>DM>NC>AO。
(内容摘自:中华医学杂志电子版,研究基金资助:上海市科委自然科学基金项目(01JC14017),上海市浦江人材计划(08J14018);作者:谢飞舟 施冬云等)