金属硫蛋白对糖尿病大鼠肾脏氧化应激的影响
张春阳,曲卫,石勇铨,邹俊杰,刘志民
(第二军医大学长征医院内分泌科,上海200003)
[摘要] 目的:观察抗氧化剂金属硫蛋白(metallothionein,MT)对糖尿病大鼠肾脏氧化应激指标及NADPH氧化酶的影响, 探讨MT对糖尿病大鼠肾脏保护作用的可能机制。方法:雄性SD大鼠随机分为正常对照组(NC,n=8)、糖尿病模型组(DM,n=7)以及糖尿病MT治疗组(DM+MT,n=8),糖尿病大鼠腹腔注射链脲佐菌素(60mg/kg)制备糖尿病大鼠模型,DM+MT组大鼠给予10 g/kg体质量MT灌胃。4周后检测各组大鼠24 h尿蛋白(24 h UP)和肾质量/体质量(KW/BW)值,评价肾脏功能,比色法检测肾脏丙二醛(MDA)含量,real-time PCR法检测NADPH氧化酶亚基p47phox、p22phox,蛋白激酶C(PKC)-和血管紧张素原(Ang)mRNA表达。结果:与NC组相比,DM组24 h UP、KW/BW以及肾皮质MDA水平明显升高(P<0.05);肾皮质p47phox、p22phox、PKC—β和Ang mRNA表达显著升高(P<0.05或P<0.01)。与DM组相比,DM+MT组24 h UP、KW/BW以及肾皮质MDA水平降低(P<0.05),p47phox、PKC-β和Ang mRNA的表达水平降低(P<0.05),而p22phox无明显改变。结论:MT可能通过降低糖尿病大鼠肾脏氧化应激水平,抑制肾皮质PKC—β、Ang以及NADPH氧化酶亚基的表达,从而发挥肾脏保护作用。
[关键词] 金属硫蛋白;糖尿病肾病;NADPH氧化酶;蛋白激酶c;血管紧张素
[中图分类号] R 587.24 [文献标识码] A [文章编号]0258—879X(2007)04—0389—04
Influence of metan0Uli0nein on kidney oxidation of diabetic rats
ZHANG Chun-yang,QU Wei,SHI Yong—quan,ZOU Jun-jie,LIU Zhi—min (Department of Endocrinology,Changzheng Hospital,Second Military Medical University,Shanghai 200003,China)
[ABSTRACT-]0bjective:To study the effect of metallothionein(MT),a potent antioxidant,on the oxidative stress and NADPH oxidase in kidneys of diabetic rats.Methods.Male SD rats were assigned to the following 3 groups:normal control(NC,n=8),diabetes mellitus control(DM,n=7),diabetes mellitus models treated with MT by lavage(10 g·kg-·d-,DM+MT,n=8).Diabetes in DM group and DM+MT group was induced by intraperitoneal injection of streptozotacin(60 mg/kg).At 4 weeks after initiating treatment,24 h urinary protein(24 h UP)and kidney weight/body weight(KW/BW)were determined in the 3 groups to assess the renal function of rats; malondialdeyde(MDA) was examined with visible spectrophotometry;NADPH oxidase subunits p47phox and p22phox,protein kinase C(PKC)-β,and Angiotensinogen(Ang) were examined by real—time PCR.Results:MDA,24 h UP and KW/BW in DM group were significantly higher than those in NC group(P<0.05);expression of PKC-β,Ang,and NADPH oxidase subunits p22phox and p47phox mRNA were increased markedly in DM group compared with NC group(P<0.05,P<0.01).24 h UP,KW/BW and MDA were significantly lower in DM+MT group compared with DM group(P<0.05);expression of p47phox,PKC-β and Ang mRNA were significantly decreased in DM+MT group compared with DM group(P<0.05),BUT p mellitus.< diabetes with rats of kidney the on effect protective activity,excerting oxidase NADPH decrease kidney,and in Ang and PKC-β expression tissues,inhibit stress lower may changes.Conclusion:MT significant no had groups DM+MT DM mRNA p22phox>
[KEY WORDS-]metallothionein;diabetic nephropathies; NADPH oxidase;protein kinase C;angiotensinogen
[Acad J Sec Mil Med Univ,2007,28(4):389—392-]
以往研究[1-2]表明长期高血糖会导致糖尿病肾病(DN)的发生和发展,良好的血糖控制能减缓DN的进展,但无法最终抑制其发展。因此,有必要寻找防治DN的新措施。近年来,氧化应激在DN发病机制中的作用逐渐受到重视。动物实验[3-4]表明糖尿病时氧化应激水平显著升高,抗氧化剂可以降低氧化应激水平,抑制DN的进展。但相关氧化剂的人体临床试验结果并不一致[5]。因此,仍需进一步研究以筛选疗效确切的抗氧化剂。
金属硫蛋白(metallothionein,MT)是一种强抗氧化剂,可直接清除羟自由基(OH.-)和O2-,发挥抗氧化作用 。有研究表明MT可能通过抑制NADPH氧化酶p47phox亚基表达,来发挥抗氧化作用,进而减轻糖尿病对心室肌收缩功能的损害。但具体机制仍不很清楚,因此,本研究观察了MT对糖尿病大鼠肾脏氧化应激指标及NADPH氧化酶的影响,进一步探讨MT对糖尿病大鼠肾脏保护作用的可能机制。
1材料和方法
1.1材料 链脲佐菌素(STZ)购自美国Sigma公司,MT由哈尔滨春源生物科技开发有限公司提供,丙二醛(MDA)测定试剂盒购自南京建成公司。血糖测定采用罗氏公司血糖测定仪。
1.2 动物分组及处理 雄性SD大鼠,体质量150~200 g,由上海实验动物中心提供。大鼠适应性饲养7 d后分组,设置正常对照组(NC)大鼠8只; 糖尿病组(DM)大鼠给予STZ(60 mg/kg)一次性腹腔注射,STZ用前以0.1 mol/L柠檬酸盐缓冲液(pH 4.5)新鲜配制,1周后尾静脉采血测定血糖,以血糖大于16.7 mmol/L确定为糖尿病模型,再随机分为2组:糖尿病模型组(DM)7只和糖尿病MT治疗组(DM+MT)8只。MT蛋粉和MT奶粉按7:3比例,以最大浓度制备成混悬液,相当于1 g MT蛋奶粉/2 ml,DM+MT组大鼠按每天10 g/kg体质量灌胃;NC和DM组大鼠予等量的生理盐水溶液灌胃。所有大鼠自由饮水,给予正常大鼠饲料,每周测量体质量和血糖。
持续给药4周后用代谢笼留24 h尿液,测尿蛋白排泄量(24 h UP)。实验动物空腹麻醉下迅速取出肾脏,称右肾质量,计算肾质量/体质量(KW/BW),分离肾皮质,-70℃低温冰箱保存,用于检测丙二醛(MDA)、NADPH氧化酶亚基p22phox和p47phox、蛋白激酶C(PKC)-β及血管紧张素原(Ang)mRNA。
1.3 肾皮质MDA含量的测定 按照MDA试剂盒说明书操作,用比色法测定。
1.4 Real—time PCR法检测肾组织PKC—β、Ang及NADPH氧化酶亚基p22phox、p47phox mRNA的表达 Ang是Ang—I1的前体,故本研究检测Ang mRNA的表达水平来间接了解肾脏组织内Ang Ⅱ的表达;为了更准确地反映待测指标mRNA表达水平在各组间的相对差异,本研究采用18 S核糖体亚基mRNA为参照,即取待测mRNA/18 S mRNA比值,消除标本量对结果的影响。
1.4.1 总RNA提取 取出冰冻100 mg肾皮质,用TRIzol提取总RNA,电泳观察RNA的浓度和完整性。
1.4.2 引物 根据GenBank提供的大鼠p22phox(NM-024160)、p47phox(NM-053734)、Ang(NM-134432)、PKC-β(NM-012713)mRNA序列,利用 Primer Premier 5.0,自行设计引物。p22phox:上游引物5’-CGG GCT GTC CTC CAC TTA CTG C-3’,下游引物5’-TGA TGG TGC CTC CAA CCT GCG-3’;p47phox:上游引物5’-GGA CAC CTA TCG CCG CAA CAG-3’,下游引物5’-GAT GAG GTC CGA GCT GGG TCT C-3’;Ang:上游引物5’-TTG TCT GGG CTG GAG CTA AAG G-3’,下游引物5’-GCA GGT GCT CTT GCT GTA GTA G-3’;PKC-β:上游引物5’-GGG CTT CGG GAA ACA GGG ATT C-3’,下游引物5’-TGG TCA CAG AAG GTA GGG CTG G-3’。引物由上海欧易生物科技有限公司合成。
1.4.3 RNA样品逆转录 利用RNA逆转录试剂 盒进行RNA逆转录。试剂盒使用TaKaRa公司的 RNA PCR kit,按照试剂盒提供的反应体系进行反转录反应。
1.4.4 Real—time PCR 利用TaKaRa公司的SYBR Premix Ex Taq(Perfect Real Time)kit进行 real—time PCR反应。PCR仪使用Corbet Research 公司Rotor—Gene3000。实验结果利用软件Rotor—Gene 5.0以及Excel 7.0进行数据分析处理。
1.4.5 标准曲线的绘制 将预试验的PCR产物按照10倍浓度梯度进行稀释,选择 1/1 000,1/10 000,1/100 000,1/1 000 000浓度的稀释产物作为标准品模板,进行real—time PCR反应。通过这4个标准品生成的反应数据,应用软件Rotor—Gene 6.0根据反应的荧光实时监控数据和标准品的浓度关系,生成标准曲线。
1.5统计学处理 采用SPSS 12.0统计软件,实验数据用 x±S表示,各组间数据差异显著性均采用t 检验处理。
2 结 果
2.1 糖尿病模型的制备情况 与NC组相比,DM 组和DM+MT大鼠血糖水平显著升高(P<0.01),体质量明显减轻(P<0.05);与DM组相比,DM+ MT组大鼠血糖和体质量没有明显改变,差异无统计学意义(表1)。
2.2 各组大鼠肾功能及MDA检测结果 如表1 所示,与NC组相比,DM组KW/BW、24 h UP和。肾皮质MDA水平均显著升高(P<0.05或0.01)。与 DM组相比较,DM+MT组大鼠KW/BW、24 h UP和。肾皮质MDA水平显著降低(P<0.05)。
表1各组大鼠血糖、体质量、肾质量/体质量、尿蛋白和MDA检测结果
Tab l Blood glucose。weight。KW/BW。24 h UP and MDA levels in each group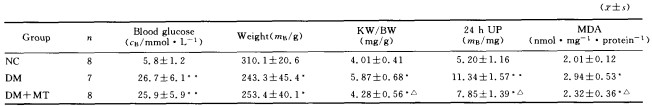
*P<0.05, P<0.01 VS NC group; P<0.05"US DM group;KW:Kidney weightiBW:Body weight;UP:Urinary protein;MDA.Malondi aldehyde
2.3 Real—time PCR检测结果
2.3.1 NADPH氧化酶亚基的表达 与NC组相比,DM+MT组和DM组p22phox mRNA表达显著升高(P<0.05),DM+MT组。肾皮质p22phox mRNA水平与DM组相比无显著差异。DM+MT 组和DM组大鼠p47phox mRNA表达水平较NC组大鼠均显著升高(P<0.05),DM+MT组 p47phox mRNA水平较DM组降(P<0.05)。详见图1A。
2.3.2 PKC-β和Ang水平 与NC组相比,DM+ MT组和DM组PKC-β和Ang mRNA表达水平显著升高(P<0.01);DM+MT组大鼠PKC-β和Ang mRNA水平较DM组显著降低(P<0.05)。详见图 1B、1C
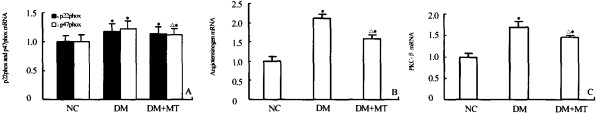
图1 各组大鼠肾组织NADPH氧化酶亚基(A)、Ang(B)以及PKC-β(C)mRNA的表达
Fig l Expression of p22phox and p47phox(A)。angiotensinogen(B) and PKC-β(C)mRNA as detected by real time PCR The levels of p22phox and p47phox,angiotensin0gen and PKCQ3 mRNA were relative to 18 s rRNA.Results were expressed relative to NC group,which were arbitrarily assigned a value of 1.0. P<0.05 V5 NC group; P<0.05 VS DM group;x±s
3 讨 论
糖尿病肾病的早期表现是。肾脏肥大,质量增加,尿蛋白水平升高。故KW/BW和24 h UP可反映糖尿病大鼠。肾脏的早期病变情况,本研究表明,MT 可使糖尿病大鼠这两项指标明显下降,减轻高血糖对肾脏的损伤,抑制糖尿病大鼠早期。肾脏病变的进展。糖尿病时氧化应激水平显著升高,NADPH氧化酶是糖尿病时高水平活性氧族(ROS)的重要来源之一[3]。为了评价MT对糖尿病大鼠肾脏氧化应激水平的影响,本研究检测了肾皮质MDA水平,结果表明,MT可部分抑制糖尿病大鼠肾脏MDA的水平。降低糖尿病大鼠。肾脏氧化应激水平,减少ROS的产生和对肾组织的损伤。
糖尿病时NADPH氧化酶处于活化状态,而抑制其活性可以降低糖尿病大鼠肾脏氧化应激水平,抑制。肾小球基质沉积,减少尿蛋白,减缓DN的进展[9]。因此,NADPH氧化酶是防治DN的一个重要靶点,包括多个亚基,其中p22phox位于细胞膜上,p47phox在细胞质内。p47phox磷酸化后可转位到细胞膜,与p22phox结合使该酶具有催化活性[10]。在肾脏系膜细胞中有p22phox和p47phox表达。高血糖时肾脏PKC-β和Ang-Ⅱ活性增强,是引起DN的重要因素,也促进p47phox表达和转位,增强NADPH氧化酶活性的作用[11-12]。
本研究结果表明,MT对PKC—β和Ang mRNA 表达有明显的抑制作用。由于Ang是Ang—Ⅱ的前体,故Ang也能间接反映肾脏Ang—Ⅱ的水平。MT对PKC—β和Ang(Ang-Ⅱ)表达的抑制作用,可间接降低p47phox亚基的表达和活性,抑制NADPH氧化酶的活性,减少ROS的产生,降低肾皮质内的氧化应激水平。
MT对NADPH亚基p22phox和p47phox的作用是不同的,对p22phox mRNA表达没有影响,对p47phox mRNA的表达则有显著的抑制作用。p47phox磷酸化后可活化NADPH氧化酶。因此,MT对p47phox的抑制可直接降低NADPH氧化酶的活化。
总之,本研究表明,MT可抑制PKC—β、Ang和 p47phox的表达,降低p47phox亚基对NADPH氧化酶的活化作用,减少肾脏R0S的产生。MT可通过抑制肾皮质内的氧化应激水平,对糖尿病大鼠的早期肾脏病变具有保护作用。
[参考文献]
[1]Diabetes Control and Complications Trial Research Group.The effect of intensive treatment of diabetes on the development and progression of long—-term complications in insulin—-dependent di·-abetes mellitus[J].N Engl J Med.1993,329:977—986.
[2]UK Prospective Diabetes Study(UKPDS)Group.Intensive blood-glucose control with su[phony[ureas or insulin compared with conventional treatment and risk of complications in pa— tients with type 2 diabetes(UKPDS 33)[J].Lancet.1998.352:837-853.
[3]Inoguchi T.Li P,Umeda F,et a1.High glucose level and free fatty acid stimulate reactive oxygen species production through protein kinase C—dependent activation of NAD(P)H oxidase in cultured vascular cellsEJ].Diabetes.2000.49:1939—1945.
[4] Koya D.Lee I K.Ishii H.et a1.Prevention of glomerular dys—function in diabetic dats by treatment with d-a—tocopherol[J].J Am Soc Nephro1.1997.8:426—435.
[5]Gaede P.Poulsen H E.Parving H H,et a1.Double-blind.ran—domised study of the effect of combined treatment with vitamin C and E on albuminuria in type 2 diabetic patients[J].Diabet Med,2001.18:756-760.
[6] Lonn E,Yusuf S.Hoogwerf B.et a1.Effects of vitamin E on cardiovascular and microvascular outcomes in high—risk patients with diabetes:results of the HOPE study and MICRO-HOPE substudy[J].Diabetes Care.2002.25:1919-27.
[7]Romero—Isart N.Vasak M.Advances in the structure and chemistry of metallothioneins[J].J Inorg Biochem.2002.88(3— 4):388—396.
[8] Wold L E,Ceylan—Isik A F.Fang C X.et a1.Metallothionein alleviates cardiac dysfunction in streptozotocin·-induced diabe·- tes:Role of Ca cycling proteins,NADPH oxidase.poly (ADP—Ribose)polymerase and myosin heavy chain isozyme [J].Free Rad Biol Med,2006.40:1419-1429.
[9]Asaba K,Tojo A.Onozato M L.et a1.Effects of NADPH oxi—dase inhibitor in diabetic nephropathy[J].Kidney Int.2005.67:l890-l898.
[10]Babior B M.Lambeth J D.Nauseef W.The neutrophil NADPH oxidase[J].Arch Biochem Biophys,2002.397:342—344.
[11]Kitada M·Koya D,Sugimoto T.et a1.Translocation of glomer—ular p47phox and p67phox by protein kinase C—beta activation is required for oxidative stress in diabetic nephropathy[J].Dia—betes.2003.52:2603-2614.
[12] Onozato M I .Tojo A.Goto A.et a1.Oxidative stress and nitric oxide synthase in rat diabetic nephropathy:effects of ACEI and ARB[J].Kidney Int.2002,61:186—194.